
طرق التحليل الإلكتروليتية
 المؤلف:
د.عبدالله محمود ابو الكباش
المؤلف:
د.عبدالله محمود ابو الكباش
 المصدر:
الكيمياء التحليلية المفاهيم الاساسية في التحليل التقليدي والالي
المصدر:
الكيمياء التحليلية المفاهيم الاساسية في التحليل التقليدي والالي
 الجزء والصفحة:
ص183 -185
الجزء والصفحة:
ص183 -185
 2024-02-11
2024-02-11
 1284
1284
يستخدم في هذا النوع من الطرق الخلية الإلكتروليتية، ففي هذه الخلية يمر تيار من مصدر خارجي، ومرور التيار في هذه الخلية سيؤدي إلى ظهور مفاهيم جديدة غير معروفة في الخلية الجلفانية. ومن بين المفاهيم التي تظهر عند مرور التيار في الخلية ما يلي:
1- الجهد الأومي:
وينشأ هذا الجهد عند مرور التيار في الخلية، حيث إن مكونات الخلية تعمل على مقاومة مرور التيار بداخلها. وهذه المقاومة تؤثر في جهد الخلية الكلي، لذا بد من زيادة في الجهد المار في الخلية من أجل التغلب على هذه المقاومة، ويطلق على الجهد الأومي . وهو عبارة عن حاصل ضرب مقاومة الخلية في شدة التيار المار بهذه الخلية، ويظهر تأثير هذا الجهد عند كتابة جهد الخلية الكلي، حيث يطرح الجهد الأومي من مكونات جهد الخلية كما يظهر في المعادلة التالية

2- الاستقطاب (Polarization)
عند مرور التيار الكهربائي في القطب يقال إن هذا القطب قد استقطب، ويعني هذا الاستقطاب أن جهد هذا القطب قد تغير واكتسب قيمة مختلفة عن تلك التي يكتسبها في حالة عدم الاستقطاب. أو بمعنى آخر في حالة عدم مرور تيار في هذا القطب. ولنبدأ بالخلية الجلفانية إذ إن هناك قطبًا في المحلول الإليكتروليتي، وأحد هذه الأقطاب يكون مصعداً وأما الآخر فهو المهبط ، وتتكون بمحاذاة كل قطب طبقة مزدوجة تتكون من جزأين : يسمى الجزء الأول الطبقة المضغوطة ( Compact layer)، وهذه سمكها بالميكروميتر، ويتم عبر هذه الطبقة تبادل الإلكترونات بين الأيونات التي في المحلول وبين سطح القطب، وتلي هذه الطبقة طبقة أخرى أكثر سمكاً، وتسمى طبقة الانتشار( diffuse layer) وفي هذه الطبقة تترتب الأيونات متجهة نحو القطب، حتى إذا ما وصلت إلى سطح الطبقة المضغوطة فسيتم تبادل الإلكترونات بين هذه الأيونات وبين سطح القطب عبر الطبقة المضغوطة. وعند الوصول لحالة الاتزان أي عندما يكون معدل الأيونات المتجهة نحو القطب مساويًا لمعدل النواتج المغادرة لسطح القطب يتكون هنا تيار يسمى تيار الانتشار ... وجهد القطب عند حالة الاتزان هذه يسمى جهد الاتزان Eeq. وفي حالة الخلية الإلكتروليتية حيث يمر التيار من المصدر الخارجي، فإن كل قطب في هذه الخلية يُعد مستقطباً. وعلى هذا الأساس يمكن تعريف الاستقطاب بأنه مرور تيار في القطب. ونتيجة لمرور التيار فإن سمك طبقة الانتشار المذكورة أعلاه يزداد بشكل ملحوظ، ومن ثُمَّ يزداد عدد الأيونات التي توجد في هذه الطبقة التي تسمى طبقة الانتشار المستفيض (Diffusion (layer) كما هو موضح في الشكل (11-1). وكنتيجة لذلك تتكون ظاهرة فوق الجهد Over voltage ، وفوق الجهد هذا يؤدي إلى تغير في جهد القطب عن قيمته في حالة الاتزان Eeq.
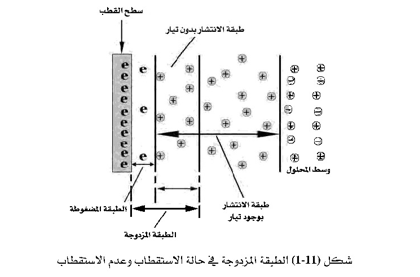
وعلى هذا الأساس فإن فوق الجهد يمثل الفرق بين جهد القطب عند مرور تيار فيه عن جهد هذا القطب في حالة عدم مرور تيار.
فوق الجهد = جهد القطب المستقطب - جهد القطب العادي

وإذا كان القطب المستقطب مصعداً فإن جهده سيكون أعلى من قيمة جهده في حالة الاتزان، وعلى العكس فإن كان القطب المستقطب مهبطاً فإن جهده يكون أقل منه في حالة الاتزان. ويمكن التعبير عن نوعين من الاستقطاب هما :
أ - الاستقطاب التركيزي (Concentration polarization):
ويحدث هذا عند نقصان معدل انتشار الأيونات في طبقة الانتشار المستفيض فيقل بذلك معدل وصولها إلى سطح القطب، كما أن معدل انتشار المواد المتفاعلة من سطح القطب إلى وسط المحلول سيتغير وهذا الاختلاف في تراكيز كل من المواد المتفاعلة والمواد الناتجة سيؤدي إلى تغير في جهد القطب حسب معادلة نيرنست.
ب- الاستقطاب التنشيطي (Activation Polarization):
وينشأ هذا الاستقطاب من بطء انتقال الإلكترونات عبر الطبقة المضغوطة، وتجدر الإشارة هنا إلى أنه في حالة سرعة تبادل الإلكترونات بين الأيونات في المحلول وسط القطب، فإن التفاعل يُعَدُّ عكسياً (Reversible) ويكون فوق الجهد التنشيطي في هذه الحالة قريباً من الصفر، أما في حالة بطء تبادل الإلكترونات عبر الطبقة المضغوطة فيزداد فوق الجهد، ويصبح التفاعل غير عكسي (Irreversible). وقد يكون مصدر هذا النوع من الاستقطاب من طبيعة التفاعل نفسه أو من ادمصاص بعض المواد على سطح القطب، وهذا بدوره يؤدي إلى بطء تبادل الإلكترونات بين الأيونات وسطح القطب، وفي مثل هذه الحالة يجب ، تنظيف سطح القطب كاملا لتقليل فوق الجهد التنشيطي.
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


