
أنواع الأقطاب
 المؤلف:
د.عبدالله محمود ابو الكباش
المؤلف:
د.عبدالله محمود ابو الكباش
 المصدر:
الكيمياء التحليلية المفاهيم الاساسية في التحليل التقليدي والالي
المصدر:
الكيمياء التحليلية المفاهيم الاساسية في التحليل التقليدي والالي
 الجزء والصفحة:
ص 162
الجزء والصفحة:
ص 162
 2024-02-10
2024-02-10
 2433
2433
تستخدم الأقطاب في كل من الخلية الجلفانية والخلية الإلكتروليتية، ويمكن تقسيم هذه الأقطاب إلى نوعين رئيسين هما الأقطاب المرجعية والأقطاب الدليلة.
1- الأقطاب المرجعية :
تتميز هذه الأقطاب بأن لها جهداً ثابتاً لا يتغير في أثناء التفاعل الذي يحدث في الخلية. ويعود ثبات جهد القطب المرجع إلى أن جهده يعتمد على أيون ثابت التركيز، فطالما كان تركيز هذا الأيون ثابتاً فسيبقى جهد هذا القطب أيضًا ثابتًا حسب معادلة نيرنست. وهناك ميزة أخرى يجب توفرها في القطب المرجع، ألا وهي سهولة تحضيره وصيانته. ومن أهم الأقطاب المستخدمة كمرجع هو قطب الهيدروجين، وقد تم اعتبار جهد هذا القطب صفراً، ومن ثُمَّ تم قياس جميع جهد الأقطاب الأخرى باستخدام هذا القطب المرجع. ولكن نظراً لعدم سهولة استعماله في التجارب العملية في المختبرات لذا تم استبداله بقطبين مرجعيين شهيرين هما :
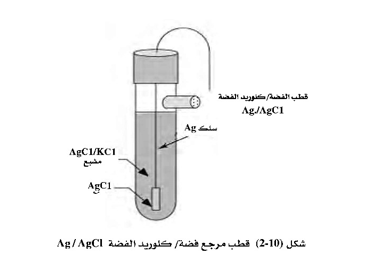
1. قطب فضة / كلوريد الفضة Ag/AgCI
وهذا القطب هو عبارة عن سلك رفيع من الفضة يوضع كمصعد في خلية إلكتروليتية بها محلول يحتوي على أيون الكلوريد ، وفي أثناء التفاعل تتكون طبقة من كلوريد الفضة تغطي سطح السلك. ومن ثُمَّ نحصل على قطب Ag/AgCl. والشكل التالي يبين تركيب هذا القطب، وهو عبارة عن سلك من الفضة مطلي بمادة كلوريد الفضة ومغمور في محلول كلوريد البوتاسيوم المشبع بكلوريد الفضة، وله غشاء منفذ للأيونات. ويعتمد هذا القطب في تفاعله على المعادلة التالية :

وحسب معادلة نيرنست فإن هذا القطب يعتمد على تركيز أيون الكلوريد ، وعند تحضيره باستخدام محلول مشبع من كلوريد البوتاسيوم فإن جهد القطب هو 0.1977+عند درجة حرارة الغرفة. وإذا كان تركيز أيون الكلوريد 3.5 مولار فإن جهد القطب يكون V0.205 + ويمكن كتابة نصف الخلية لهذا القطب كالتالي:
حيث x عبارة عن تركيز كلوريد البوتاسيوم.
2. قطب الكالوميل المشبع :
يُعد هذا القطب المرجع الأكثر استعمالاً، ويبين الشكل (10-2) تركيب هذا القطب، حيث يتكون من أنبوبة داخلية معبأة بعجينة من الزئبق ومادة الكالوميل Hg2Cl2 في وجود محلول مشبع من كلوريد الكالسيوم والأنبوبة الداخلية موضوعة بداخل أنبوبة خارجية مملوءة بمحلول مشبع من كلوريد البوتاسيوم KCI. وتتصل الأنبوبتان عن طريق فتحة بأسفل الأنبوبة الداخلية كما في الشكل (10-2).
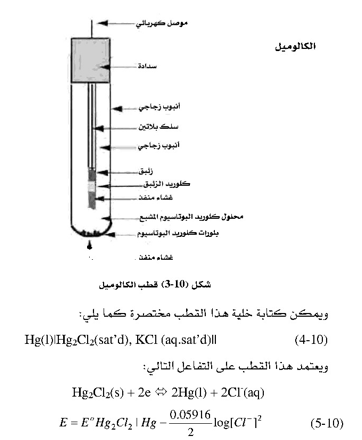
وكما نرى من هذه المعادلة أن جهد هذا القطب يعتمد على تركيز أيون الكلوريد. وباستخدام تركيز ثابت لأيون الكلوريد يمكننا الحصول على قطب مرجع ذي جهد ثابت، وهذا هو مبدأ عمل الأقطاب المرجعية. وبما أن محلول الكلوريد يكون مشبعاً فإن جهد قطب الكالوميل سيكون ثابتا له قيمة محددة هي0.244 فولت. وستتغير هذه القيمة في حال استخدام محلول كلوريد ذي تركيز مختلف.
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


