
حالة الاتزان ومعنى جهد القطب
 المؤلف:
د.عبدالله محمود ابو الكباش
المؤلف:
د.عبدالله محمود ابو الكباش
 المصدر:
الكيمياء التحليلية المفاهيم الاساسية في التحليل التقليدي والالي
المصدر:
الكيمياء التحليلية المفاهيم الاساسية في التحليل التقليدي والالي
 الجزء والصفحة:
ص 120-121
الجزء والصفحة:
ص 120-121
 2024-02-07
2024-02-07
 1566
1566
حين وجود المعدن كقطب في خلية وبدخول ذرات هذا المعدن في التفاعل، فإن ذرة هذا المعدن تفقد الإلكترونات فيتكون بذلك أيون المعدن. فلو أخذنا قطعة من الخارصين Zn ووضعناها في كأس به ماء، فإن ذرة Zn تفقد إلكترونين، وهذه الإلكترونات تبقى على السطح أما الأيون +2Zn فإنه يذهب في الماء. وتستمر هذه العملية حتى يزداد تركيز الأيونات حول قطعة الخارصين، ومن ثم تبدأ هذه الأيونات بأخذ إلكترونات من على سطح القطب وتترسب. وفي الوقت نفسه تتحول ذرات من Zn من القطعة إلى+2 Zn وتفقد إلكترونين، ويصبح هذا النظام في حالة اتزان عندما يكون معدل مغادرة الأيونات لسطح المعدن مساوياً لمعدل ترسب الذرات المختزلة (من الأيونات التي في المحلول) على سطح القطب. وعند هذه النقطة يكون هناك شحنة سالبة ثابتة على سطح قطعة المعدن، وكذلك يكون هناك عدد من أيونات الخارصين في المحلول، ولو قمنا باستبدال قطعة الخارصين بقطعة النحاس فإن هذه الظاهرة ستحدث، لكن بما أن النحاس أقل فاعلية من الخارصين فعند الوصول إلى حالة الاتزان فإن الشحنة السالبة على سطح قطعة النحاس ستكون أقل من مثيلتها على قطعة الخارصين، ومن ثم فإن عدد أيونات النحاس في المحلول سيكون قطعاً أقل من عدد أيونات الخارصين في حالة الاتزان. والشكل التالي يبين هذه الظاهرة بوضوح :
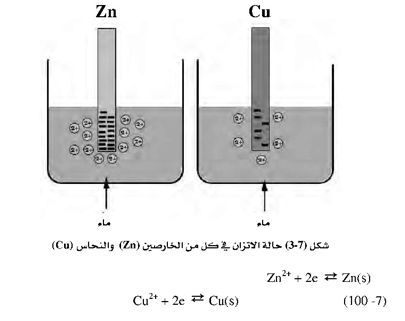
ولتوضيح الفرق في الجهد في حالتي الاتزان في كل من الخارصين والنحاس ففي حالة الخارصين يكون فرق الجهد بين الشحنات الموجبة التي في المحلول وبين الشحنات السالبة المتكونة على سطح القطب كبيراً. أما في حالة الاتزان في النحاس فإن هذا الفرق في الجهد يكون أقل منه في حالة الخارصين. وحتى نتمكن من قياس هذا الفرق في الجهد لا بد من توصيل القطب في حالة الخارصين أو النحاس بقطب الهيدروجين المرجع وبهذا يمكن تعيين الجهد القياسي للعديد من المعادن والجزيئات. وعادة يتم إجراء هذه القياسات عند الحالة القياسية، وهي درجة الحرارة 25 درجة مئوية، وضغط الهيدروجين 1 ضغط جوي وتركيز محلول أيونات المعدن هو 1.0 مولار.
ونتيجة لهذه القياسات تم الحصول على سلسة الدافعة الكهربية (electromotive series) وعلى هذا الأساس فإن الجهد القياسي للمعدن المغمور في محلول 1.0 مولار من أيونات هذا المعدن هو عبارة عن الجهد المقاس عند توصيل قطب هذا المعدن مع قطب الهيدروجين. وبمعنى آخر فإن هذا الجهد القياسي يمثل الفرق في الجهد بين الشحنة الموجبة في المحلول والشحنة السالبة على سطح المعدن عند حالة الاتزان في هذا المعدن وبين الفرق في الجهد بين الشحنة الموجبة في المحلول والشحنة السالبة على سطح قطب البلاتين عند حالة الاتزان في قطب الهيدروجين. ولقد أعطي قطب الهيدروجين اصطلاحا القيمة صفر فولت.
والمقارنة قوة كل من المواد المؤكسدة والمواد المختزلة تم تحديد الجهد القياسي (standard potential ) للعديد من العناصر والأيونات والجزيئات، حيث تم إنشاء خلية جلفانية تتكون من وعائين يجري بكل وعاء تفاعل يمثل نصف الخلية. ففي الوعاء الأول يتم تفاعل الأكسدة وفي الثاني يتم الاختزال. ولقد تم اصطلاحا اختيار قطب الهيدروجين ليكون القطب المرجع، وأُعطي جهد هذا القطب القيمة صفر، وتمت مقارنة الجهد القياسي للعديد من التفاعلات باستخدام هذا القطب كقطب مرجع.
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


