

النبات

مواضيع عامة في علم النبات

الجذور - السيقان - الأوراق

النباتات الوعائية واللاوعائية

البذور (مغطاة البذور - عاريات البذور)

الطحالب

النباتات الطبية


الحيوان

مواضيع عامة في علم الحيوان

علم التشريح

التنوع الإحيائي

البايلوجيا الخلوية


الأحياء المجهرية

البكتيريا

الفطريات

الطفيليات

الفايروسات


علم الأمراض

الاورام

الامراض الوراثية

الامراض المناعية

الامراض المدارية

اضطرابات الدورة الدموية

مواضيع عامة في علم الامراض

الحشرات


التقانة الإحيائية

مواضيع عامة في التقانة الإحيائية


التقنية الحيوية المكروبية

التقنية الحيوية والميكروبات

الفعاليات الحيوية

وراثة الاحياء المجهرية

تصنيف الاحياء المجهرية

الاحياء المجهرية في الطبيعة

أيض الاجهاد

التقنية الحيوية والبيئة

التقنية الحيوية والطب

التقنية الحيوية والزراعة

التقنية الحيوية والصناعة

التقنية الحيوية والطاقة

البحار والطحالب الصغيرة

عزل البروتين

هندسة الجينات


التقنية الحياتية النانوية

مفاهيم التقنية الحيوية النانوية

التراكيب النانوية والمجاهر المستخدمة في رؤيتها

تصنيع وتخليق المواد النانوية

تطبيقات التقنية النانوية والحيوية النانوية

الرقائق والمتحسسات الحيوية

المصفوفات المجهرية وحاسوب الدنا

اللقاحات

البيئة والتلوث


علم الأجنة

اعضاء التكاثر وتشكل الاعراس

الاخصاب

التشطر

العصيبة وتشكل الجسيدات

تشكل اللواحق الجنينية

تكون المعيدة وظهور الطبقات الجنينية

مقدمة لعلم الاجنة


الأحياء الجزيئي

مواضيع عامة في الاحياء الجزيئي


علم وظائف الأعضاء


الغدد

مواضيع عامة في الغدد

الغدد الصم و هرموناتها

الجسم تحت السريري

الغدة النخامية

الغدة الكظرية

الغدة التناسلية

الغدة الدرقية والجار الدرقية

الغدة البنكرياسية

الغدة الصنوبرية

مواضيع عامة في علم وظائف الاعضاء

الخلية الحيوانية

الجهاز العصبي

أعضاء الحس

الجهاز العضلي

السوائل الجسمية

الجهاز الدوري والليمف

الجهاز التنفسي

الجهاز الهضمي

الجهاز البولي


المضادات الميكروبية

مواضيع عامة في المضادات الميكروبية

مضادات البكتيريا

مضادات الفطريات

مضادات الطفيليات

مضادات الفايروسات

علم الخلية

الوراثة

الأحياء العامة

المناعة

التحليلات المرضية

الكيمياء الحيوية

مواضيع متنوعة أخرى

الانزيمات
Lambda Repressor Dimers Bind Cooperatively to the Operator
المؤلف:
JOCELYN E. KREBS, ELLIOTT S. GOLDSTEIN and STEPHEN T. KILPATRICK
المصدر:
LEWIN’S GENES XII
الجزء والصفحة:
7-6-2021
2389
Lambda Repressor Dimers Bind Cooperatively to the Operator
KEY CONCEPTS
- Repressor binding to one operator increases the affinity for binding a second repressor dimer to the adjacent operator.
- The affinity is 10 times greater for OL1 and OR1 than other operators, so they are bound first.
- Cooperativity allows repressor to bind the OL2/OR2 sites at lower concentrations.
Each operator contains three repressor-binding sites. As can be seen in FIGURE 1, no two of the six individual repressorbinding sites are identical, but they all conform to a consensus sequence. The binding sites within each operator are separated by spacers of 3 to 7 bp that are rich in A-T base pairs. The sites at each operator are numbered so that OR consists of the series of binding sites OR1-OR2-OR3, whereas OL consists of the series OL1-OL2-OL3. In each case, site 1 lies closest to the start point for transcription in the promoter, and sites 2 and 3 lie farther upstream.
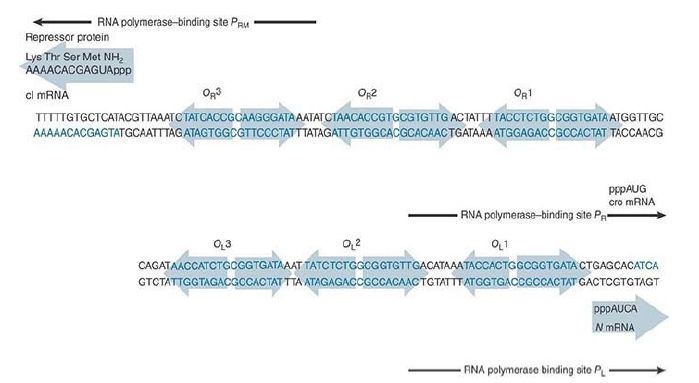
FIGURE 25.24 Each operator contains three repressor-binding sites and overlaps with the promoter at which RNA polymerase binds. The orientation of OL has been reversed from usual to facilitate comparison with OR .
Faced with the triplication of binding sites at each operator, how does the lambda repressor decide where to start binding? At each operator, site 1 has a greater affinity (roughly 10-fold) than the other sites for the lambda repressor. Thus, it always binds first to OL1 and OR1.
Lambda repressor binds to subsequent sites within each operator in a cooperative manner. The presence of a dimer at site 1 greatly increases the affinity with which a second dimer can bind to site 2. When both sites 1 and 2 are occupied, this interaction does not extend farther, to site 3. At the concentrations of the lambda repressor usually found in a lysogen, both sites 1 and 2 are filled at each operator, but site 3 is not occupied.
The C-terminal domain is responsible for the cooperative interaction between dimers, as well as for the dimer formation between subunits. FIGURE 2 shows that it involves both subunits of each dimer; that is, each subunit contacts its counterpart in the other dimer, forming a tetrameric structure.
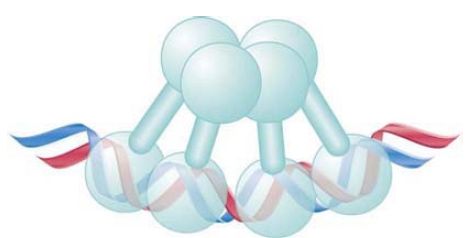
FIGURE 2. When two lambda repressor dimers bind cooperatively, each of the subunits of one dimer contacts a subunit in the other dimer.
A result of cooperative binding is the increase in effective affinity of repressor for the operator at physiological concentrations. This enables a lower concentration of repressor to achieve occupancy of the operator. This is an important consideration in a system in which release of repression has irreversible consequences. In an operon coding for metabolic enzymes, after all, failure to repress will merely allow unnecessary synthesis of enzymes. Failure to repress lambda prophage, however, will lead to induction of phage and lysis of the cell.
The sequences indicate that OL1 and OR1 lie more or less in the center of the RNA polymerase binding sites of PL and PR , respectively. Occupancy of OL1-OL2 and OR1-OR2 thus physically blocks access of RNA polymerase to the corresponding promoters.
 الاكثر قراءة في مواضيع عامة في الاحياء الجزيئي
الاكثر قراءة في مواضيع عامة في الاحياء الجزيئي
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















