
Molecular Orbitals from p Atomic Orbitals
 المؤلف:
University of Missouri System
المؤلف:
University of Missouri System
 المصدر:
Introductory chemistry
المصدر:
Introductory chemistry
 الجزء والصفحة:
.................
الجزء والصفحة:
.................
 17-11-2020
17-11-2020
 2765
2765
Molecular Orbitals from p Atomic Orbitals
To determine the molecular orbitals of many other molecules, we need to examine how p orbitals combine to give molecular orbitals. The p orbitals can overlap in two ways: head-to-head or sideways. Head-to-head overlap of p atomic orbitals results in a bonding and antibonding molecular orbital, where the electron density is centred along the internuclear axis, making them σ orbitals (Figure1.1 “Head-to-head overlap of p orbitals”).

Figure1.1. Head-to-head overlap of p orbitals.
Sideways overlap of the remaining four p atomic orbitals can occur along the two other axes, generating four π molecular orbitals having electron density on opposite sides of the internuclear axis (Figure1.2 “Sideways overlap of p orbitals”).

Figure1.2. Sideways overlap of p orbitals.
The head-to-head overlap giving σ molecular orbitals results in greater overlap, making its bonding molecular orbital the most stable and lowest energy, while the σ* antibonding is least stable and has the highest energy (Figure1.3 “Molecular orbital energy diagram for homonuclear diatomic molecules made from atoms of atomic number 8-10″). Sideways overlap gives four π molecular orbitals, two lower-energy degenerate-bonding molecular orbitals, and two higher-energy antibonding orbitals.

Figure1.3. Molecular orbital energy diagram for homonuclear diatomic molecules made from atoms of atomic number 8-10.
The energy diagram we have just generated fits experimentally with O2, F2, and Ne2, but does not fit for B2, C2, and N2. In the latter, homonuclear diatomic molecules (B2, C2, and N2), interactions take place between the 2s and 2p atomic orbitals that are strong enough to swap the ordering of the σ2p and π2p molecular orbitals (Figure 1.4).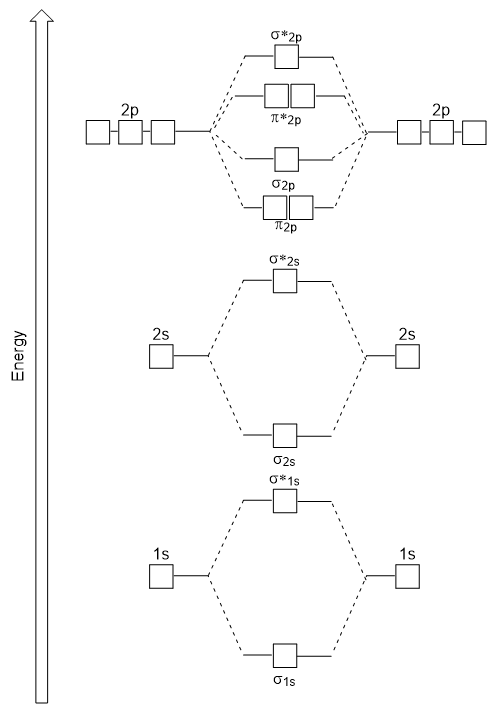
Figure 1.4. Molecular orbital energy diagram for homonuclear diatomic molecules made from atoms of atomic number 5-7.
 الاكثر قراءة في مواضيع عامة في الكيمياء اللاعضوية
الاكثر قراءة في مواضيع عامة في الكيمياء اللاعضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


