


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2-10-2018
التاريخ: 2025-01-11
التاريخ: 2025-04-19
التاريخ: 11-5-2017
|
هناك أكثر من تعريف للحموض والقواعد أقدمها كان تعريف أرهينيوس Arrhenius (1884م) حيث يطلق على المركبات التي لها القدرة على التأين في المحلول المائي معطية أيونات هيدروجين اسم حموض بينما يطلق على المركب قاعدة عندما يكون له القدرة على التأين ويعطي أيون هيدروكسيد. ولكن تعريفات الحموض والقواعد التي تلت هذا التعريف كانت أشمل.
نظرية برونستد - لوری Bronsted-Lowry: يعرف الحمض طبقا لنظرية . لورى بأنه المركب الذي له القدرة على إعطاء البروتون، في حين تعرف القاعدة بأنها المركب الذى له القدرة على تقبل البروتون.

في المعادلة السابقة لابد وأن ينظر إلى التفاعل بالاتجاه العكسي (إلى اليسار) لأنه عند الاتزان، يسير كلا الاتجاهين للتفاعل إلى اليمين وإلى اليسار) بسرعة متساوية. وفي الاتجاه الأيسر فإن + HB تمثل الآن الحمض في حين يمثل القاعدة، أي أن القاعدة الأصلية أصبحت تمثل حمضا والحمض الأصلي أصبح يمثل القاعدة. وحتى يتم تمييز الحمض والقاعدة في كلا الحالتين (كفتي المعادلة) فإن الحمض والقاعدة التي إلى الكفة اليمنى من المعادلة يطلق عليهما
الحمض المرافق والقاعدة المرافقة وعليه فإن X- هو القاعدة المرافقة لـ HX وCL- القاعدة المرافقة لـ HCI و HSO-4 القاعدة المرافقة لـ H2SO4 و CN- القاعدة المرافقة لـ HCN. وهكذا لأن كلاً من هذه المواد تكونت عند فقد البروتون من الحمض
الأصلي ولها القدرة على أن تتقبل البروتون كي يتكون الحمض الأصلي في الاتجاه العكسي.

وفي تفاعلات الحموض والقواعد في المحاليل المائية فإنه من القاعدة يمكن حساب ثابت الحمضية Ka من العلاقة التالية:

ومن التقدير التقدير الكمي لثابت الحموضة (Ka) فإنه يمكن تقدير جهة اتزان التفاعل وهذا بدوره يؤدي إلى استنباط ما إذا كان الحمض قوياً أو ضعيفاً. فثابت الحموضة هذا هو مقياس الحموضة أي أنه كلما كان صغيراً كلما كان الحمض ضعيفاً أي أن الاتزان جهة اليسار. وعليه يمكن مقارنة قوة الحموضة لحموض مختلفة وذلك من مقارنة ثوابت حموضة هذه الحموض. هذا وتختلف درجة تاين الحموض باختلاف المذيبات. وما ذكر أعلاه عن Ka وعلاقته لقوة الحموضة أو ضعفها يمكن تطبيقه على Kb وعلاقته بقوة القاعدية أو ضعفها..
نظرية لويس (1938) Lewis وفقاً لنظرية لويس فإن أي مادة (جزيئات أو أيونات) لها القدرة على تقبل زوج الكتروني فإن لها صفة حمضية. أما المادة التي لها القدرة على إعطاء زوج الكتروني فإن لها صفة قاعدية كما يتضح من الأمثلة التالية قاعدة لويس حمض لويس
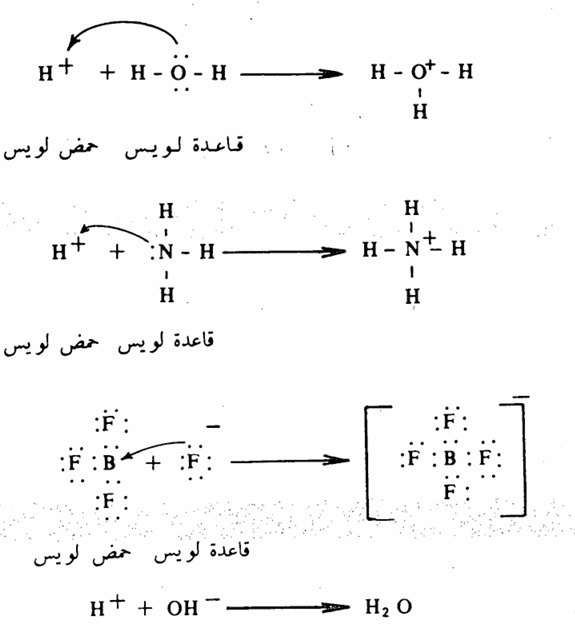
فحموض لويس هي تلك المفتقرة للإلكترونات وقد تكون متعادلة أو ذات شحنة موجبة. أما قواعد لويس فهي تلك الغنية بالإلكترونات ويجب أن تحوي زوجاً الكترونياً حراً واحداً على الأقل وقد تكون متعادلة أو ذات شحنة سالبة.

لا تختلف نظرية لويس عن نظرية برونستد لورى فيما يتعلق بالمركبات القاعدية، فأي مادة لها القدرة على إعطاء زوج الكتروني (قاعدة لويس)، لها القدرة على إعطاء هذا الزوج الالكتروني إلى البروتون (قاعدة برونستد لورى). فأيون الهيدروكسيد مثلاً يمثل قاعدة لويس أو قاعدة برونستد لورى. ومع ذلك فكثير من حموض لويس لا تنطبق وتعريف برونستد من لورى للحموض من بين ذلك هاليد البورون وهاليدات الحديد والألومنيوم، فالمعادن في جميع هذه الهاليدات يوجد بمدارها الخارجي ست الكترونات فقط وعليه فإن لها القدرة على تقبل الالكترونات.



|
|
|
|
دراسة: حفنة من الجوز يوميا تحميك من سرطان القولون
|
|
|
|
|
|
|
تنشيط أول مفاعل ملح منصهر يستعمل الثوريوم في العالم.. سباق "الأرنب والسلحفاة"
|
|
|
|
|
|
|
الطلبة المشاركون: مسابقة فنِّ الخطابة تمثل فرصة للتنافس الإبداعي وتنمية المهارات
|
|
|