


 النبات
النبات
 الحيوان
الحيوان
 الأحياء المجهرية
الأحياء المجهرية
 علم الأمراض
علم الأمراض
 التقانة الإحيائية
التقانة الإحيائية
 التقنية الحيوية المكروبية
التقنية الحيوية المكروبية
 التقنية الحياتية النانوية
التقنية الحياتية النانوية
 علم الأجنة
علم الأجنة
 الأحياء الجزيئي
الأحياء الجزيئي
 علم وظائف الأعضاء
علم وظائف الأعضاء
 الغدد
الغدد
 المضادات الحيوية
المضادات الحيوية|
أقرأ أيضاً
التاريخ: 2-11-2021
التاريخ: 10-9-2021
التاريخ: 16-11-2021
التاريخ: 14-9-2021
|
تخلق الخلية إنزيمات لتعمل بداخلها الإنزيمات داخل الخلوية intracellular enzymes) أو خارجها (الإنزيمات خارج الخلوية intracellular enzymes أو ectoenzymes). فإذا تم إفراز الإنزيم خارج الخلوي جاهزاً للعمل فإنه يُدعى باسم الزيماز zymase، إلا أن الخلايا تُخلقُ بعض البروتينات وتفرزهــا علـــى شكل بروتينات عاطلة تُعرف باسم طلائع البروتينات . فإذا كانت هذه البروتينات إنزيمات، تسمى هذه الطلائع باسم طلائع الإنزيمات أو سلائف الإنزيمات pre-enzymes أو مولدات الإنزيمات zymogens.
يتضمن تحويل مولد الإنزيم إلى إنزيم ناضج فعّال عملية الحل البروتيني الانتقائي التي تتضمن واحدة أو أكثر من "عمليات القص" المتتابعة الحالة للبروتين والتي تفضي إلى إزالة جزء من السلسلة الببتيدية يدعى "ببتيد الإحصار blocking peptide"، حيث إنه يغطي الموقع الفعال للإنزيم ويحصر عمله:
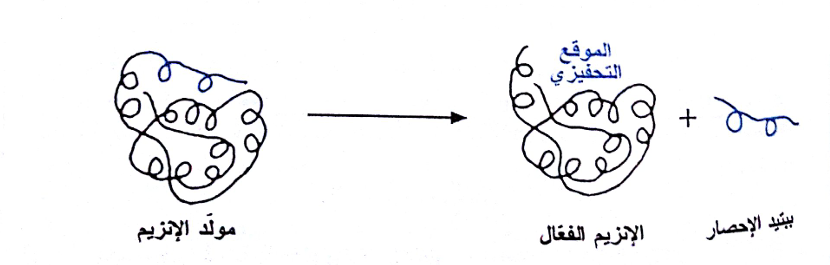
(شكل1)
ومن الأمثلة على الإنزيمات المصنعة كطلائع نذكر كلا من الإنزيمات الهاضمة: الببسين والتربسين والكيمو تربسين (طلائع الإنزيمات هي مولد الببسين ومولد التربسين ومولد الكيموتربسين، على التوالي) وعوامل مختلفة مشاركة في شلال تخثر وذوبان خثرة الدم . ويتم تحويل هذه المولدات إلى إنزيمات فعالة إما ذاتيا autocatalysis أو بوساطة إنزيم عامل آخر (انظر الشكل 2).
فعلى سبيل المثال، طليعة الكيموتربسين pro-CT هي عديد ببتيد مكون من 245 ثمالة أمينو أسيل، وتتضمن عملية تحويلها إلى الإنزيم الفعال، ألفا-كيموتربســــين، ثلاث عمليات قص حال للبروتين وتشكيل متوسط نشيط معروف باسم الكيموتربسين-π ) π-CT) (الشكل 3). تبقى السلاسل A وB وC في الكيموتربسين -ألفا مرتبطةً لأن هناك اثنتين من الروابط ثنائية السلفيد بين السلاسل في هذا الإنزيم.

( شكل 2)
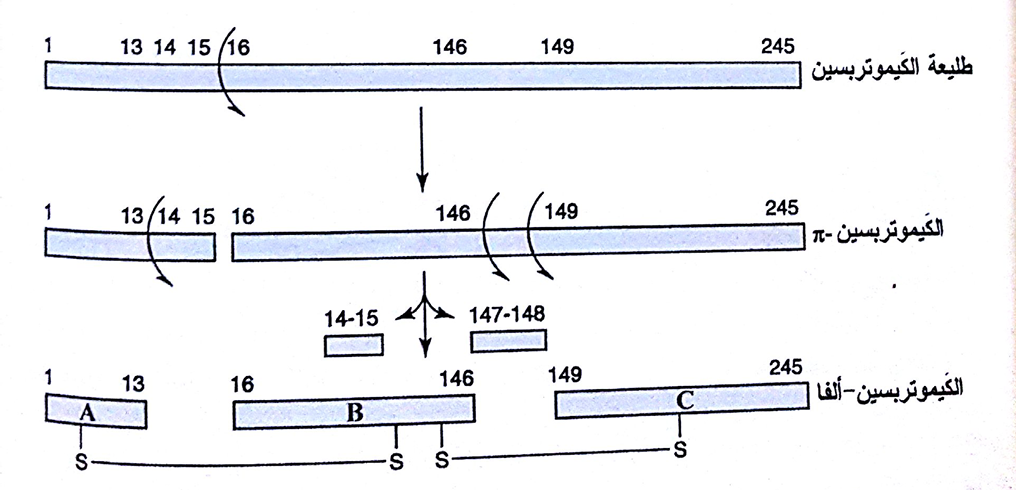
(شكل3) تحويل طليعة الكيموتربسين الى الشكل الفعال ( الكيموتربسين الفا )
لماذا تُفرز بعض البروتينات بشكل عاطل ؟ إن بعض البروتينات ضرورية في الأوقات كلها بشكل أساسي وبعضها الآخر (كإنزيمات تشكيل خثرة الدم وحلّها) ضروري فقط بشكل متقطع، والحاجـــة للإنزيمات الأخيرة غالباً ما تكون فورية. وتكون بعض العمليات الفيزيولوجية كالهضم متقطعة، ولكنها منتظمة وقابلة للتكهن بها إلى حد ما. وهناك عمليات أخرى، كتشكل خثرة الدم وذوبانهــا وتــرميم النسيج، من الضروري أن تُصبح جاهزةً في الحال استجابة للحاجة الفيزيولوجية أو الفيزيولوجية المرضية الملحة؛ ويمكن إدراك أهمية الزمن في عمليات تشكل خثرة الدم وذوبانها لتحقيق الاستتباب.
وكذلك فإن تخليق البروتيازات كبروتينات طليعية عاطلة تحفيزيا يفيد في حماية النسيج الذي نشأت منه (مثل البنكرياس) من الهضم الذاتي. ويمكن ألا يكون استحداث البروتينات (تخليقها من جديــــد) الضرورية سريعاً بشكل كاف للاستجابة للطلب الفيزيولوجي المرضي الملح كحالة الترف مثلاً. إضافةً لذلك، يجب توفر تجميعة pool كافية وكاملة من الحموض الأمينية الطليعية. وكذلك يمكن أن تكون عملية الإفراز بطيئة نسبةً إلى الحاجة الفيزيولوجية.
استنتاجات من تنشيط طليعة الكيموتر بسين
يوضح مثالُ تحويل طليعة البروتين إلى شكله الناضج الفعّال فيزيولوجياً المبادئ العامة التالية لعمليات تحويل طليعة البروتين إلى بروتين:
- تتضمن العملية حل البروتين الانتقائي (عملية قص واحدة حالة للبروتين في بعض الحالات).
- يمكن أن تنفصل عديدات الببتيد الناتجة أو أن تبقى مرتبطةً في البروتين الناضج.
- يمكن أن تترافق العملية بتغير كبير في الوزن الجزيئي الذي قد لا يتغير أيضاً.
- تحقيق هيئة conformation جديدة للبروتين هو من النتائج الرئيسة لحل البروتين الانتقائي.
- إذا كانت طليعة البروتين إنزيماً، فإن تغير الهيئة المذكور آنفاً يولّد المقرَّ التحفيزي. وفي الواقع، يمكن النظر إلى حل البروتين الانتقائي لطليعة إنزيم على أنها العملية التي تُثير تغيرات أساسية في الهيئة تؤدي إلى "إحداث" المقر التحفيزي أو كشفه .

|
|
|
|
النوم 7 ساعات ليلا يساعد في الوقاية من نزلات البرد
|
|
|
|
|
|
|
اكتشاف مذهل.. ثقب أسود ضخم بحجم 36 مليار شمس
|
|
|
|
|
|
|
مركز ويلسون الأمريكي ينشر مقالًا للمركز العراقي لتوثيق جرائم التطرف عن أهمية أرشفة جرائم البعث
|
|
|